Introducción: El Cáncer es Genético, pero no siempre Hereditario
Si hay una frase que escuchamos a diario en la Fundación Dr. Eduardo Nishihara García, es: "Nadie en mi familia tuvo cáncer, ¿por qué yo?" o la inversa, "Todos en mi familia tuvieron, ¿estoy condenado?".
Para los estudiantes de medicina y profesionales de la salud, distinguir entre la biología molecular del tumor y la herencia germinal es el primer paso hacia la medicina de precisión.
Sabemos que todo cáncer es genético (se produce por acumulación de mutaciones en el ADN de la célula), pero solo entre un 5% y un 10% de los cánceres son hereditarios. Entender esta diferencia no es solo teoría académica; es la clave para salvar no solo a un paciente, sino a generaciones enteras.
1. La Clasificación Clínica: Esporádico vs. Familiar vs. Hereditario
Para realizar una anamnesis correcta, debemos clasificar al paciente en uno de tres grupos:
Cáncer Esporádico (70-80%): Ocurre por azar o factores ambientales (tabaco, radiación, edad). Las mutaciones son somáticas (solo en el tumor). No se transmiten a los hijos.
Cáncer Familiar (15-20%): Vemos una agrupación de casos en la familia, pero sin un patrón claro de herencia mendeliana. Probablemente sea una combinación de genes de baja penetrancia y factores ambientales compartidos.
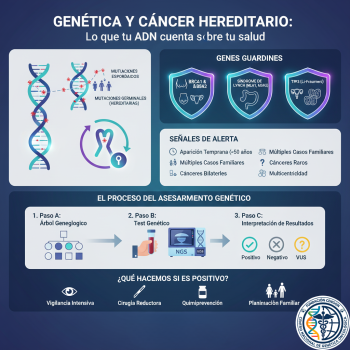
Cáncer Hereditario (5-10%): Existe una mutación germinal en un gen de alta penetrancia (ej. BRCA1, MLH1). Esta mutación está presente en todas las células del cuerpo desde la concepción y se transmite con un patrón (usualmente) Autosómico Dominante.
2. La Fisiopatología: La Hipótesis de los "Dos Golpes" de Knudson
Para el residente de oncología o genética, recordar a Alfred Knudson es vital. La mayoría de los síndromes de cáncer hereditario afectan a Genes Supresores de Tumores (los "frenos" del ciclo celular).
Primer Golpe (Germinal): El paciente nace con un alelo mutado heredado de uno de sus padres. Todas sus células ya tienen este "defecto". Sin embargo, el otro alelo funciona bien, por lo que el fenotipo es normal.
Segundo Golpe (Somático): A lo largo de la vida, una célula pierde el segundo alelo funcional (por azar o ambiente).
Resultado: La célula pierde su capacidad de frenar la división o reparar el ADN, iniciando la carcinogénesis mucho antes que en la población general.
3. Los Síndromes "Flagship" que debes conocer
Más allá de BRCA, la medicina moderna exige conocer los síndromes clave:
A. Síndrome de Cáncer de Mama y Ovario Hereditario (HBOC)
Genes: BRCA1, BRCA2 (principalmente), PALB2, TP53, PTEN.
Fisiología: Fallo en la reparación del ADN por recombinación homóloga.
Riesgos: Mama (hasta 80%), Ovario (hasta 40-60%), Páncreas, Próstata (en hombres) y Melanoma.
B. Síndrome de Lynch (Cáncer Colorrectal Hereditario No Polipósico)
Genes: MLH1, MSH2, MSH6, PMS2 (Sistema Mismatch Repair - MMR).
Fisiología: Inestabilidad de Microsatélites (MSI). El ADN no corrige errores de replicación.
Riesgos: Colon, Endometrio (muy alto en mujeres), Ovario, Estómago, Urotelio.
Dato Clínico: Son tumores que suelen responder muy bien a la Inmunoterapia.
C. Síndrome de Li-Fraumeni
Gen: TP53 (El "Guardián del Genoma").
Riesgos: Sarcomas, Mama premenopáusica, Cerebro, Adrenocortical. Es un síndrome devastador con riesgos desde la infancia.
4. Red Flags: ¿Cuándo derivar a Genética?
Como médico de atención primaria o especialista, debes encender la alarma si ves:
🚩 Edad Temprana: Cáncer de mama <45 años, Colon <50 años.
🚩 Bilateralidad: Cáncer en ambas mamas o riñones.
🚩 Múltiples Primarios: Un mismo paciente con cáncer de colon y luego endometrio.
🚩 Cáncer "Raro": Cáncer de mama en varón (sugiere BRCA2) o carcinoma medular de tiroides.
🚩 Agregación Familiar: Tres o más familiares directos con el mismo tipo de cáncer (o relacionados).
5. Del Sangre al Dato: La Era del NGS (Next Generation Sequencing)
Atrás quedaron los días de analizar un gen por vez (Sanger). En la Fundación Dr. Nishihara utilizamos Paneles Multigénicos mediante NGS.
Esto nos permite secuenciar simultáneamente 30, 80 o más genes asociados al cáncer.
Ventaja: Mayor tasa de detección diagnóstica en menos tiempo.
Desafío: La aparición de VUS (Variantes de Significado Incierto). Son cambios en el ADN que aún no sabemos si son benignos o patogénicos. El manejo de una VUS requiere criterio clínico experto: no se opera a un paciente por una VUS.
6. La Utilidad Clínica: ¿Para qué sirve saberlo?
El diagnóstico genético cambia la conducta médica (Clinical Management):
Prevención Quirúrgica: Mastectomía profiláctica (reduce riesgo >90%) o Salpingooforectomía (extirpación de ovarios/trompas).
Vigilancia de Alto Riesgo: Resonancia Magnética mamaria anual desde los 25 años (en vez de mamografía a los 40).
Tratamiento Dirigido: Uso de Inhibidores de PARP (como Olaparib) en pacientes con cáncer de ovario/mama BRCA mutado. Estos fármacos atacan la debilidad específica de las células tumorales (Letalidad Sintética).
La genética oncológica ha dejado de ser una ciencia del futuro para convertirse en el estándar de cuidado actual. Identificar una mutación hereditaria no es dar una mala noticia; es entregar un mapa de ruta para anticiparse a la enfermedad.
En la Fundación Dr. Eduardo Nishihara García, estamos comprometidos con la formación continua y el acceso a estas tecnologías. Si eres estudiante o residente, te invitamos a acercarte y conocer más sobre nuestros programas de rotación y educación.